اسید بنزوئیک چیست؟
اسید بنزوئیک یک ترکیب آلی است که با فرمول شیمیایی C6H5COOH توصیف میشود. این ترکیب از یک گروه کربوکسیل متصل به یک حلقه بنزن تشکیل شده است. بنابراین، اسید بنزوئیک را یک اسید کربوکسیلیک آروماتیک مینامند. این ترکیب در شرایط عادی به صورت یک جامد کریستالی بیرنگ وجود دارد. اصطلاح “بنزوات” به استرها و نمکهای C6H5COOH اشاره دارد.
تولید تجاری اسید بنزوئیک از طریق اکسیداسیون جزئی تولوئن با اکسیژن، کاتالیز شده توسط نفتناتهای منگنز یا کبالت انجام میشود. این واکنش شیمیایی در زیر نشان داده شده است.
اسید بنزوئیک، یک اسید کربوکسیلیک آروماتیک ساده، یک جامد کریستالی سفید با بوی ملایم و خوشایند است. این یک ترکیب همه کاره با طیف وسیعی از کاربردها، به ویژه در صنعت غذا به عنوان یک نگهدارنده است.
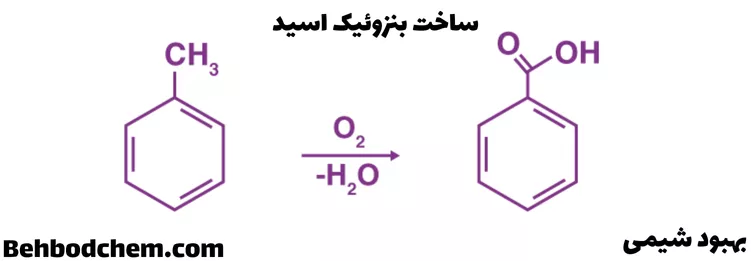 روش صنعتی دیگر برای تهیه Benzoic acid، واکنش تریکلروتولوئن با هیدروکسید کلسیم در حضور آب و سپس تیمار محصول بنزوات کلسیم با اسید هیدروکلریک است.
روش صنعتی دیگر برای تهیه Benzoic acid، واکنش تریکلروتولوئن با هیدروکسید کلسیم در حضور آب و سپس تیمار محصول بنزوات کلسیم با اسید هیدروکلریک است.
ساختار
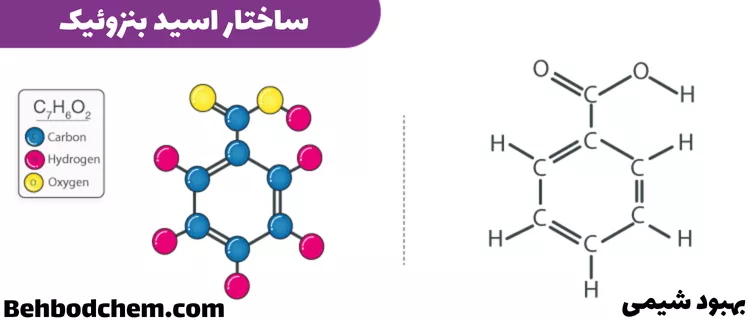
ساختار یک مولکول C6H5COOH در زیر نشان داده شده است. این مولکول از یک حلقه بنزن تشکیل شده است که یک گروه عاملی کربوکسیل به آن متصل است. این مولکول شامل ۷ اتم کربن، ۶ اتم هیدروژن و ۲ اتم اکسیژن است.
 خواص فیزیکی و شیمیایی اسید بنزوئیک
خواص فیزیکی و شیمیایی اسید بنزوئیک
خواص فیزیکی:
- ظاهر: جامد کریستالی سفید
- بو: بوی ملایم و خوشایند
- نقطه ذوب: ۱۲۲ درجه سانتیگراد (۳۹۵ کلوین)
- نقطه جوش: ۲۵۰ درجه سانتیگراد (۵۲۳ کلوین)
- چگالی: ۱.۲۶۶ گرم بر سانتیمتر مکعب در ۱۵ درجه سانتیگراد
- حلالیت:
- کمی محلول در آب
- محلول در حلالهای آلی مانند استون، بنزن، الکل، اتر و غیره
- ساختار کریستالی: مونوکلینیک
خواص شیمیایی:
- اسیدیته: اسید بنزوئیک یک اسید ضعیف با pKa برابر با ۴.۲ است. این بدان معناست که میتواند یک پروتون (H+) را در محلولهای آبی اهدا کند.
- واکنشها:
- دکربکسیلاسیون: هنگام حرارت دادن با آهک سودا (مخلوطی از هیدروکسید سدیم و اکسید کلسیم)، اسید بنزوئیک گروه کربوکسیل خود را از دست میدهد و بنزن تشکیل میدهد.
- استریفیکاسیون: با الکلها در حضور یک کاتالیزور اسیدی واکنش میدهد تا استرهایی تشکیل دهد که اغلب به عنوان عوامل طعم دهنده استفاده میشوند.
- کاهش: Benzoic acid میتواند با استفاده از عوامل کاهنده مانند هیدرید آلومینیوم لیتیوم (LiAlH4) به الکل بنزیل کاهش یابد.
- هالوژناسیون: واکنشهای جانشینی الکتروفیلی با هالوژنها (مانند کلر یا برم) را برای تشکیل اسیدهای بنزوئیک هالوژنه انجام میدهد.
- نیتراسیون: اسید بنزوئیک میتواند با استفاده از مخلوطی از اسید نیتریک غلیظ و اسید سولفوریک نیتراته شود تا اسیدهای نیتروبنزوئیک تشکیل شود.
کاربردهای اسید بنزوئیک
- نگهدارنده غذا: اسید بنزوئیک و نمکهای آن (بنزوات سدیم و بنزوات پتاسیم) به طور گسترده به عنوان نگهدارندههای غذایی برای جلوگیری از رشد کپکها، مخمرها و باکتریها استفاده میشوند.
- واسطه در سنتز شیمیایی: به عنوان ماده اولیه برای سنتز ترکیبات آلی مختلف، از جمله رنگها، عطرها و داروها استفاده میشود.
- کاربردهای دارویی: Benzoic acid و مشتقات آن کاربردهای دارویی دارند، مانند درمان عفونتهای قارچی و آکنه.
- واکنشگر آزمایشگاهی: در آزمایشگاهها برای اهداف مختلف، از جمله کالیبراسیون pH متر و به عنوان یک استاندارد در آزمایشهای تیتراسیون استفاده میشود.
- تولید فنول
- این ترکیب در پمادهایی که از بیماریهای قارچی پوست جلوگیری یا درمان میکنند، استفاده میشود.
- Benzoic acid یکی از مواد تشکیل دهنده بسیاری از محصولات آرایشی و بهداشتی مانند رژ لب است.
- همچنین پیشساز کلرید بنزوئیل است که در ساخت مواد شیمیایی، رنگها، عطرها، علفکشها و داروها کاربرد دارد.
- یکی از اجزای خمیر دندان، دهانشویه و کرمهای شستشوی صورت است.
- این ترکیب همچنین در تولید رنگ و دفع حشرات استفاده میشود.
فروش عمده بنزوئیک اسید در بهبود شیمی
شرکت بهبود شیمی به عنوان یکی از واردکنندگان رسمی اسید بنزوئیک این محصول را در اشکال، پودری، گرانول و پرک به صورت عمده به فروش میرساند. جهت خرید این محصول با کارشناسان فروش ما در ارتباط باشید.
 ملاحظات ایمنی:
ملاحظات ایمنی:
- Benzoic acid به طور کلی در غلظتهای مجاز برای استفاده در محصولات غذایی بیخطر در نظر گرفته میشود.
- با این حال، میتواند باعث تحریک پوست و چشم شود.
- استنشاق بخارات آن ممکن است باعث تحریک دستگاه تنفسی شود.
اطلاعات خطر اسید بنزوئیک
| کلاس خطر | بیانگر خطر | نماد |
|---|---|---|
| خوردگی/تحریک پوست، دسته ۲ | H315 – باعث تحریک پوست میشود | ! |
| آسیب جدی چشم/تحریک چشم، دسته ۱ | H318 – باعث آسیب جدی چشم میشود | ☠ |
| سمیت خاص برای اندام هدف (ریهها)، قرار گرفتن در معرض مکرر، دسته ۱ | H372 – باعث آسیب به اندامها (ریهها) از طریق قرار گرفتن در معرض طولانی مدت یا مکرر میشود | ☠ |
| خطرناک برای محیط آبی، خطر حاد، دسته ۳ | H402 – برای موجودات آبزی مضر است |
فروش اسید بنزوئیک
شرکت بهبود شیمی بنزوئیک اسید گرید صنعتی را در بستهبندیهای 25 کیلوگرمی محصول کشور آلمان و چین به فروش میرساند. جهت خرید این محصول با کارشناسان فروش ما در ارتباط باشید.
سؤالات متداول در مورد اسید بنزوئیک:
اسید بنزوئیک در آب خیلی محلول نیست. با این حال، حلالیت این ترکیب در آب با افزایش دما افزایش مییابد (همانطور که در مورد اکثر ترکیبات صادق است). در دمای 0 درجه سانتیگراد، حلالیت اسید بنزوئیک در آب معادل 1.7 گرم در لیتر است. با گرم شدن تا 100 درجه سانتیگراد، حلالیت این ترکیب در آب به 56.31 گرم در لیتر افزایش مییابد. در صنعت، اسید بنزوئیک را میتوان با استفاده از گاز اکسیژن برای اکسیداسیون جزئی تولوئن تهیه کرد. لازم به ذکر است که این فرآیند معمولاً از نفتنات منگنز یا کبالت به عنوان کاتالیزور استفاده میکند. این ترکیب همچنین میتواند از طریق هیدرولیز بنزامید و بنزونیتریل تهیه شود. همچنین میتوان آن را با اکسید کردن بنزیل کلرید یا بنزیل الکل یا هر مشتق دیگری از گروه بنزیل تهیه کرد. پیوند دوگانه حلقه بنزن به دلیل دلالوکالیزاسیون، الکتروندهی کمتری دارد که باعث تخریب ویژگی آروماتیک حلقه بنزن میشود. بنابراین، اسید بنزوئیک اسید قویتری نسبت به اسید آکریلیک است. گروه آمینو اثر +R و اثر I ضعیفی را نشان میدهد. از آنجایی که گروه -NH₂ بازی است در حالی که گروه -COOH اسیدی است، بنابراین، o-آمینوبنزوئیک اسید از طریق پیوند هیدروژنی تشکیل زویتریون میدهد. در نتیجه، اثر اورتو تا حدی کاهش مییابد که o-آمینوبنزوئیک اسید به اسیدی ضعیفتر از اسید بنزوئیک و حتی اسید ضعیفتر از m-آمینوبنزوئیک تبدیل میشود. در واقع، به دلیل اثر +R قوی، همه اسیدهای آمینه اسیدهای ضعیفتری نسبت به اسید بنزوئیک هستند.


 خواص فیزیکی و شیمیایی اسید بنزوئیک
خواص فیزیکی و شیمیایی اسید بنزوئیک ملاحظات ایمنی:
ملاحظات ایمنی:








نقد و بررسیها
هنوز بررسیای ثبت نشده است.